Número: 3.3 - 5 Artigo(s)
- Imprimir
- Indicar
- Estatísticas
- (0) Comentários
- Como Citar
- Download Citação
- Artigos Relacionados
- Outros dos Autores
Artigos Originais
Avaliação do quadro de estresse metabólico em ratos Wistar intoxicados com Aflatoxina B1
Avaliation of the stress metabolic in Wistar rats intoxicated with aflatoxin B1
Rosângela Aguilar da Silva1; Rinaldo Henrique Aguilar-da-Silva2
1. Doutora em Ciências - Coordenadoria de Controle de Doenças da Secretaria de Estado da Saúde. Pesquisador científico do Instituto Adolfo Lutz
2. Doutor em Genética e Evolução – Universidade Federal de São Carlos. Docente da Faculdade de Medicina de Marília
Resumo
As aflatoxinas são metabólitos secundários produzidos pelas espécies do gênero Aspergillus (A. parasiticus, A. flavus, A. nomius). Esses fungos são contaminantes naturais dos alimentos e suas micotoxinas podem causar várias doenças no homem e nos animais, constituindo um fator de risco importante para o carcinoma hepatocelular. A aflatoxina B1 (AFB1) exerce seus efeitos após conversão hepática em AFB1-epóxido, pela ação de enzimas do citocromo P-450, o qual reage com macromoléculas celulares, incluindo proteínas, RNA e DNA. O presente trabalho teve como objetivo avaliar, por meio de análises bioquímicas e morfológicas, os efeitos da administração da AFB1 em ratos Wistar machos. Os animais receberam uma dose diária de 0.25 mg/Kg de peso corpóreo durante 10 dias. Em seguida, os ratos foram sacrificados; o sangue e o fígado foram coletados para as análises bioquímicas e morfológicas. Os resultados referentes as análises do sangue não mostraram diferenças estatisticamente significativas para glicose, creatinina, ácido úrico e função hepática, quando comparadas com o grupo controle. Entretanto, a atividade da superóxido dismutase, a capacidade antioxidante do plasma, e os níveis da glutationa reduzida e grupamentos sulfidrila, foram significativamente diferentes dos grupos controles. Em relação à análise morfológica, a avaliação macroscópica não revelou anormalidades hepáticas e, na microscopia, observou-se ausência de infiltrado inflamatório e presença de raros hepatócitos, Esses resultados evidenciam a presença de estresse oxidativo em um modelo sub-crônico, o que torna preocupante a exposição à AFB1, ainda que a níveis baixos.
Palavras-chave: Intoxicação, Aflatoxina B1, Estresse Metabólico, Ratos Wista
INTRODUÇÃO
As aflatoxinas são um grupo de toxinas relativamente estáveis produzidas por três espécies de Aspergillus: A. flavus, A. parasiticus e pela rara espécie A. nomius. Atualmente, são conhecidos 17 compostos similares designados pelo termo aflatoxina, mas os principais tipos de interesse médico-sanitário são identificados como B1, B2, G1 e G2 (Organización Panamericana de la Salud, 1983).
Em condições favoráveis de temperatura e umidade, esses fungos crescem em certas rações e alimentos, resultando na produção das aflatoxinas. As contaminações ocorrem com maior intensidade em nozes, pistaches e castanhas brasileiras, pecans, amendoins e outras
sementes oleosas e são geralmente encontradas na associação com vários alimentos e rações, em diferentes proporções.
As aflatoxinas são absorvidas no trato gastrointestinal e biotransformadas primariamente no fígado, por enzimas microssomais do sistema de funções oxidases mistas (Biehl e Buck, 1987). Essas enzimas, pertencentes à superfamília de enzimas do citocromo P-450 e constituem parte do processo de detoxificação de uma ampla variedade de xenobióticos no organismo (Hsieh e Atkinson, 1991).
O contaminante encontrado com maior freqüência em produtos utilizados diretamente na alimentação é a aflatoxina B1, AFB1, considerada a mais tóxica do grupo.
Existe consenso entre grande número de especialistas de que a AFB1 é na realidade um pró-carcinógeno, o qual requer ativação metabólica para manifestar seus efeitos tóxicos (Oliveira e Germano, 1997).
A forma ativada da AFB1 é o composto identificado como 8,9-óxido de AFB1, ou AFB1-epóxido (anteriormente denominado AFB1-2,3-epóxido), originado graças à epoxidação da dupla ligação do éter vinílico, presente na estrutura bi-furanóide da molécula de AFB1 (Forrester et al. 1990). Esse composto é altamente eletrofílico e capaz de reagir rapidamente, por intermédio de ligações covalentes, com sítios nucleofílicos de macromoléculas, como ácido desoxirribonucléico (DNA), ácido ribonucléico (RNA) e proteínas. Estas ligações determinam a formação de adutos, os quais representam a lesão bioquímica primária produzida pelas aflatoxinas (Hsieh; Atkinson, 1991). A AFB1-epóxido pode também ser conjugada enzimaticamente com glutationa reduzida (GSH) por meio de glutationa-S-transferase, constituindo importante via de detoxificação desse composto, (Hayes et al., 1991).
A ligação da AFB1-epóxido com o DNA modifica a sua estrutura e, conseqüentemente, a sua atividade biológica, dando origem assim aos mecanismos básicos dos efeitos mutagênicos e carcinogênicos da AFB1 (Hsieh e Atkinson, 1991).
Diversos autores consideram que a potência dos efeitos da AFB1, bem como a dos seus derivados, sobre células ou organismos, depende, entre outros fatores, do balanço integrado entre as múltiplas vias, tanto de ativação metabólica, quanto de detoxificação (Massey et al., 1995).
Essas modificações hepáticas interferem diretamente no metabolismo intermediário e podem ocasionar o chamado estresse metabólico. Nesta condição, o organismo utiliza-se de mecanismos adaptativos numa tentativa de restabelecer o equilíbrio. Um desses mecanismos é a ativação de vias, como a das Pentoses Fosfato, para tentar elevar as concentrações da glutationa reduzida (GSH) e, assim, contribuir na detoxificação do AFB1-epóxido.
O objetivo deste trabalho foi avaliar estresse metabólico e possíveis efeitos hepatotóxicos em ratos Wistar intoxicados com AFB1, a partir do estabelecimento de técnicas eritrocitárias para monitoramento do estresse, bem como da análise das características morfológicas do fígado.
MÉTODOS
Animais, Dietas e Tratamento
Foram analisados 24 ratos (Wistar) machos, adultos, sadios, com aproximadamente 75 dias de idade e 300 gramas de peso, provenientes do Biotério central da Faculdade de Medicina de Marília. O delineamento experimental foi o inteiramente casualizado. Os animais foram distribuídos em 2 grupos de 12; a esses dois grupos denominou-se controle e experimental; foram mantidos em ambiente com controle de temperatura (22 – 24 ºC) e com ciclo de claro/escuro de 12 em 12 horas. Além disso, tiveram os animais livre acesso à água e ração. O grupo experimental foi tratado com aflatoxina via oral pela técnica de gavagem (Waynforth e Flecknall, 1992), com dose de 0,25 mg/Kg, por um período de 10 dias (Liu et al., 1988). O grupo "controle" recebeu da mesma forma solução salina 0,9%. Após o período de tratamento, os animais foram, anestesiados e sacrificados. O sangue foi coletado por meio de punção cardíaca. Esse sangue foi processado e utilizado nas determinações bioquímicas.O fígado do animal foi retirado, pesado e posteriormente utilizado na determinação dos níveis de glicogênio hepático e análise morfológica.
2. Determinações Bioquímicas
Determinou-se glicose, ácido úrico, creatinina, atividade de transaminases AST e ALT por meio de Kits comerciais, superóxido distmutase e glutationa reduzida de acordo com Beutler (1984), grupamentos sulfidrila (Faure e Lafond, 1995), capacidade antioxidante do plasma conforme Benzie e Strain (1996) e glicogênio segundo Vilela et al. (1978).
3. Análise Morfológica
Os cortes histológicos foram submetidos à coloração Hematoxilina-Eosina (HE), para a análise morfológica, e à reação imunohistoquímica do TUNEL (terminal deoxynucleotidyl transferase-mediated dUTP nick end labeling), para a evidenciação de apoptose.
4. Análise Estatística
Para cada uma das variáveis bioquímicas, foram calculadas média, desvio padrão e o teste de correlação linear. O teste t de Student foi utilizado para avaliar as variáveis paramétricas (Snedecor, 1946). As variáveis não-paramétricas foram analisadas com base na prova da soma das ordens de WILCOXON – MANN – WHITNEY (Zar, 1974). O nível de significância escolhido para essa análise foi de uma prova bilateral (a=0,05).
RESULTADOS
1. Análise Bioquímica
A tabela 1 apresenta os valores médios e os desvios-padrão das determinações de glicemia, ácido úrico, transaminases ALT e AST, creatinina, superóxido dismutase (SOD), grupo sulfidrila total (GST), glutationa reduzida (GSH), capacidade antioxidante do plasma (FRAP) e glicogênio hepático.
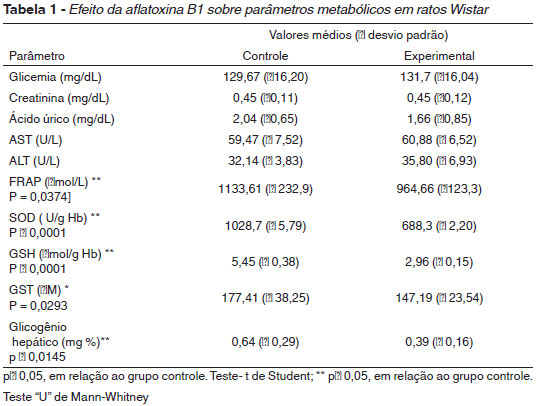
Os resultados da presente pesquisa têm demonstrado que, em um nível de significância de 5%, os valores obtidos de capacidade antioxidante do plasma no grupo experimental foram significantemente diferentes do grupo controle, revelando uma diminuição de aproximadamente 15% quando comparadas as médias dos dois grupos. Isso caracteriza um estado de estresse oxidativo. A capacidade antioxidante do plasma (FRAP) revela o potencial antioxidante, diminuída sempre que um quadro de estresse oxidativo se estabelece.
O outro marcador de defesa antioxidante estudado foi a concentração de grupamento sulfidrila total (GST) no plasma. Esse parâmetro relaciona-se principalmente aos resíduos de cisteína, presentes em proteínas plasmáticas, sobretudo de GSH que, durante o ataque oxidativo, são alvos preferenciais (Halliwell e Gutteridge, 1984).
DISCUSSÃO
Uma diminuição significativa dos níveis de GST foi observada no grupo experimental, o que reforça a hipótese de estresse oxidativo. Além disso, o teste estatístico demonstrou haver uma correlação entre os níveis de GSH e GST, corroborando o trabalho de Halliwell e Gutteridge (1984). Essa diminuição reflete a alteração oxidativa das proteínas; trata-se de um marcador específico da presença de dano oxidativo, bem como da diminuição do arsenal das defesas antioxidantes (FRAP), as quais estariam sendo usadas para neutralizar os radicais livres gerados, minimizando seus danos sobre as estruturas celulares.
As análises de glutationa reduzida (GSH) demonstraram que, para um nível de significância de 5%, os valores obtidos para o grupo experimental foram significantemente diferentes do grupo controle, revelando uma diminuição de aproximadamente 46% entre os dois grupos. A explicação para tal diminuição é o tipo de estresse oxidativo a que foi submetido o grupo experimental. No estresse sub-crônico, a situação encontra-se invertida: ao invés de um aumento de GSH, o que evidenciamos foi uma diminuição dos seus níveis. Isso se deve a que, durante o processo de proteção, ocorre uma diminuição transitória de GSH, vez que esta pode ser conjugada ou oxidada a GSSG. A perda da oxidação é reversível, porque a GSSG é reduzida mais uma vez para a forma funcional por meio da glutationa redutase. Já a glutationa conjugada é exportada da célula e processada em ácidos mercaptúricos, que são excretados na urina, tornando o processo de regeneração irreversível. Nessa condição torna-se necessária uma nova síntese de GSH. Esse fato foi evidenciado por diversos autores (Arrick et al., 1982, Lopes-Torres et al., 1993), os quais descreveram que uma diminuição ocorre, preferencialmente, após um estresse não crônico, porque em condições de intenso estresse, a taxa de formação de GSSG por meio da oxidação de GSH supera a capacidade da enzima glutationa redutase.
Os resultados das atividades de SOD foram significativamente diferentes (p < 0,05) revelando uma diminuição de aproximadamente 33%, quando comparadas as médias dos dois grupos. Em casos de estresse oxidativo crônico, a SOD geralmente se encontra aumentada para fazer frente à elevação dos radicais livres presentes no sistema biológico. Contudo, em estudos com o modelo de exposição aguda (Rastogi et al., 2001), observaram a diminuição da atividade da SOD, da catalase, bem como do conteúdo da GSH hepáticas. Kakkar et al. (1998) e Damasceno et al. (2004) investigando o estresse oxidativo em ratos diabéticos, também encontraram diminuição da atividade da SOD e atribuem esse fato à inativação da enzima, devido ou ao efeito de glicosilação decorrente da hiperglicemia ou ao conseqüente acúmulo de H2O2.
A diminuição da SOD, apesar de parecer contraditória, pode ainda ser secundária ao efeito da exposição à AFB1 sobre o desenvolvimento de deficiências nutricionais, inclusive de zinco (Williams et al., 2004), cofator dessa enzima, e cuja atividade seria prejudicada, agravando o quadro de estresse oxidativo.
Os resultados das análises de ácido úrico, revelaram não existir uma diferença estatística significativa entre os dos dois grupos. Isso se contrapõe a diversos estudos que encontraram níveis de ácido úrico aumentados. Entretanto, é importante considerar que a dose de AFB1 utilizada neste estudo, parece não ativar os mecanismos adaptativos suficientemente para elevar os níveis de ácido úrico. Além disso, a faixa de normalidade dos níveis de ácido úrico é bastante ampla e pequenas variações ocorrem com freqüência sem, no entanto, ultrapassar a faixa de normalidade. Nesse sentido, a não-elevação dos níveis de ácido úrico pode ser inferida pela correlação estatística estabelecida entre ácido úrico e capacidade antioxidante total (para o grupo controle, r = 0,7388; para o grupo experimental, r = 0,5796). Ou seja, as variações nos níveis de ácido úrico estão correlacionados às variações dos níveis de FRAP justificando sua contribuição efetiva no potencial antioxidante, consumo e não-elevação dos seus níveis.
Os dados referentes a atividade das transaminases (ALT) e (AST) indicaram não existir uma diferença estatisticamente significativa entre os grupos experimental e controle. Isso é corroborado pela análise histológica do fígado, que também mostrou não haver áreas de necrose que justifiquem o extravasamento das enzimas para o sangue periférico. Ao que tudo indica, a intoxicação do grupo experimental na dose proposta, não foi suficiente para alterar as estruturas celulares do fígado.
Um outro biomarcador de estresse metabólico é a creatinina. Ela é um produto da degradação da fosfocreatina. O sistema ATP-Fosfocreatina constitui um sistema imediato de energia para a contração muscular de rápida duração. É liberada na circulação e excretada pela urina. A quantidade excretada diariamente é constante e seus níveis no plasma ou no soro pouco diferem. Dessa forma, ela torna-se um sensível indicador de função renal. Quando aumentados no sangue, tais níveis sugerem um quadro de insuficiência renal com conseqüente lesão celular. Não foram encontradas grandes diferenças entre as médias dos dois grupos analisados, isso vem confirmar a hipótese da presença de estresse oxidativo, inferindo a ausência de lesão tecidual nos ríns.
Em relação aos níveis de glicose, os resultados demonstraram não haver diferenças significativas entre os grupos. Isso se contrapõe ao quadro de estresse oxidativo, em que mais glicose é requerida para a manutenção da integridade das membranas eritrocitárias. Uma possível explicação para esse fato é a diminuição dos níveis de glicogênio hepático, encontrado no grupo experimental de aproximadamente 39%, que é uma fonte constante de glicose para o sangue. Além disso, estudos com a utilização de modelos de intoxicação aguda por AFB1 evidenciam efeitos sobre a produção de energia (Doherty et al., 1972, 1973 e Sajan et al., 1996). A toxina pode atuar diretamente sobre o sistema transportador de elétrons (Obidoa, 1986) e tal ação causaria uma depleção do ATP e a impossibilidade da utilização celular de substratos dependentes do metabolismo aeróbio, criando uma submissão exclusiva da produção anaeróbia de energia, via glicólise. Conseqüentemente, os estoques de glicogênio seriam mobilizados (Mclean e Dutton, 1995, Verna e Choudhary, 1995, Rastogi et al., 2001).
Em uma situação subcrônica, os resultados aos quais se chegou podem indicar similaridade, ainda que mais brandamente, com o sistema aeróbio de produção de energia. Uma possibilidade seria de que, às expensas da utilização do glicogênio, manter-se-iam valores glicêmicos no grupo exposto a AFB1 semelhantes ao grupo controle. Tal hipótese pode ser corroborada pela evidência de que os efeitos sobre a produção de energia parecem ocorrer em concentrações menores que as necessárias (McLean e Dutton, (1995); Verna e Choudhary (1995)). Adicionalmente, a possível ativação da Via das Pentoses poderia indicar uma adaptação à presença do estresse oxidativo.
2. Análise Morfológica
A avaliação macroscópica não revelou anormalidades hepáticas quanto à coloração e à consistência do órgão nos grupos "controle" e "experimental".
À microscopia de luz, foi observada, nas secções coradas pela Hematoxilina-Eosina, uma organização estrutural típica, veias centrais normais, ausência de infiltrado inflamatório e presença de raros hepatócitos com núcleos picnóticos e cromatina condensada sugestiva de apoptose, tanto no grupo "controle" como no tratado (figuras 1 e 2).
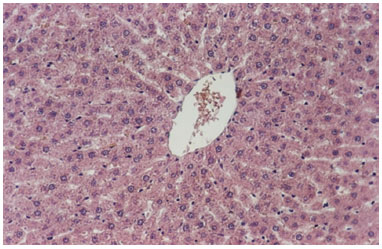
Figura 1. Fotomicrografia de secção transversal de fígado de rato. Observar a veia central do lóbulo hepático e núcleos de hepatócitos. Grupo tratado. H.E. 100X.
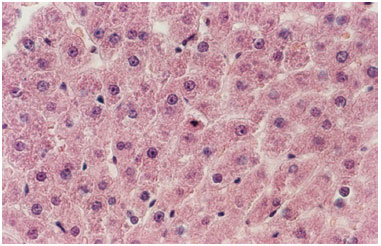
Figura 2. Fotomicrografia de secção transversal de fígado de rato. Observar núcleo picnótico de hepatócito com cromatina condensada, sugestivo de apoptose. Grupo controle. H.E. 400X.
A investigação da presença de células em processo de apoptose pelo método do TUNEL revelou raras células positivas no grupo "controle" e no grupo "experimental" (figuras 3 e 4), sendo estas: os hepatócitos e as células de Kupffer (macrófagos migratórios).
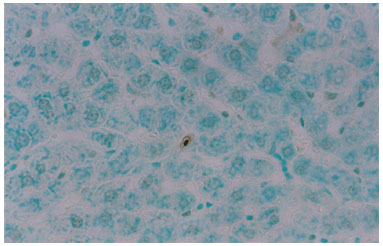
Figura 3. Fotomicrografia de secção transversal de fígado de rato submetida ao método TUNEL. Núcleos de hepatócitos em processo de apoptose. Grupo Tratado. 400X.
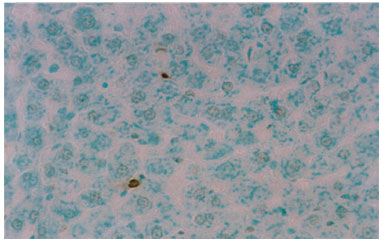
Figura 4. Fotomicrografia de secção transversal de fígado de rato submetida ao método TUNEL. Núcleos de hepatócitos em processo de apoptose. Grupo controle. 400X.
CONCLUSÃO
As alterações enzimáticas e funcionais do metabolismo eritrocitário detectadas em ratos experimentalmente intoxicados com aflatoxina B1 estão associadas aos sistemas de proteção antioxidante e/ou de elevação dos níveis de radicais livres, ocasionando um aumento dos danos oxidativos eritrocitários. A detecção deste quadro experimental, é preocupante e constitui um alerta ao sistema de Vigilância em Saúde no sentido de desenvolver sistemas de investigação direta da exposição dos seres humanos a esta toxina.
REFERÊNCIAS
1. Arrick BA, Nathan CF, Griffith OW, Cohn ZA. Glutathione depletion sensitizes tumor cells to oxidative cytolysis. J Biol Chem 1982;257:1231-7.
2. Benzie IFF, Strain JJ. The ferric reducing ability of plasma (FRAP) as a measure of "antioxidant power": the FRAP assay. Anal Biochem 1996;239(1):70-6.
3. Beutler E. Red cell metabolism: a manual of biochemical methods. 3.ed. New York: Grune & Stratton; 1984.
4. Biehl ML, Buck WB. Chemical contaminants: their metabolism and their residues. J Food Protec 1987;50:1058-73.
5. Damasceno DC, Volpato GT, Calderon IMP, Aguilar R, Rudge MVC. Effect of Bauhinia forficata extract in diabetic pregnant rats: maternal repercussions. Phytomedicine 2004;11:196-201.
6. Doherty WP, Campbell TC. Inhibition of rat liver mitochondrial electron transport flow by aflatoxin B1. Res Commun Chem Pathol Pharmacol 1972;3:601-12.
7. Doherty WP, Campbell TC. Aflatoxin inhibition of rat liver mitochondria. Chem Biol Interact 1973;7:63-77.
8. Faure P, Lafond JL. Measurement of plasma sulphydryl and carbonyl groups as a possible indicator of protein oxidation. In: Favier AE et al (Eds.). Analysis of free radicals in biological systems. Basel: Birkhäuser Verlag 1995;237-48.
9. Forrester LM, Neal GE, Judah DJ, Glancey MJ, Wolf CR. Evidence for involvement of multiple forms of cytochrome P-450 in aflatoxin B1 metabolism in human liver. Proc Natl Acad Sci 1990;87:8306-10.
10. Halliwell B, Gutteridge, JMC. Oxygen toxicity, oxygen radicals, transition metals and disease. Biochem J 1984;219:1-4.
11. Hayes JD, Judah DJ, Mclellan LI, Neal GE. Contribution of the glutathione-S-transferases to the mechanisms of resistence to aflatoxin B1. Pharmacol Ther 1991;50:443-72.
12. Hsieh DPH, Atkinson DN. Bisfuranoid mycotoxins: their genotoxicity and carcinogenicity. Adv Exp Med Biol 1991;283:525-32.
13. Liu Y-L, Roebuck BD, Yager JD, Groopman JD, Kensler TW. Protection by 5-(2-pyrazinyl)-4-methyl-1,2-dithiol-3thione (oltipraz) against the hepatoxicty of aflatoxin B1 in the rat 1988;93:442-451.
14. Kakkar R, Mantha SV, Radhi J, Prasad K, Kalra J. Increased oxidative stress in rat liver and pancreas during progression of streptozotocin-induced diabetes. Clinical Science 1998,94:623-32.
15. Lopes-Torres M, Perez-Campo R, Cadenas S, Rojas C, Barja G. A comparative study of free radical in vertebrates II: non-enzymatic antioxidants and oxidative stress. Comp Biochem Physiol B 1993;105(3-4):757-63.
16. Massey TE, Stewart RK, Daniels JM, Liu L. Biochemical and molecular aspects of mammalian susceptibility to aflatoxin B1 carcinogenicity. Proc Soc Exp Biol Med 1995;208:213-27.
17. Mclean M, Dutton MF. Cellular interactions and metabolism of aflatoxin: an update. Pharmacol Ther 1995;65:163-92.
18. Obidoa O. Aflatoxin inhibition of rat liver mitochondrial cytochrome oxidase activity. Biochem Med Metab Biol 1986;5(3):302-7.
19. Oliveira CAF, Germano PML. Aflatoxinas: conceitos sobre mecanismos de toxicidade e seu envolvimento na etiologia do câncer hepático celular. Rev Saúde Pública 1997;31:4.
20. Organización Panamericana de la Salud. Micotoxinas. Washington, 1983. (Critérios de Salud Ambiental, 11).
21. Rastogi R, Srvastava AK, Rastogi, AK. Biochemical canges induced in liver and serum of aflatoxin B1-treated male Wistar rats: preventive effect of picroliv. Pharmacology & Toxicology 2001;88(2):53-8.
22. Sajan MP, Satav JG, Bhattacharya RK. Alteration of energy-linked functions in rat hepatic mitochondria following aflatoxin B1 administration. J Biochem Toxicol 1996;11(5):235-41.
23. Verna RJ, Choudhary SB, "Hypercalcaemia During Aflatoxicosis," Med Sci Res 1995.
24. Villela GG, Bacila M, Tastaldi. Bioquímica. 4. Ed. Rio de Janeiro: Editora Guanabara Koogan; 1978.
25. Waynforth H, Flecknall P. Experimental and surgical techniques in the rat. 2nd New York: Academic Press; 1992.
26. Williams JH, Phillips TD, Jolly PE, Stiles JK, Jolly CM, Aggarwal D. Human aflatoxicosis in developing countries: a review of toxicology, exposure, potential health consequences, and interventions. Am J Clin Nutr 2004;80:1106-22.



