Número: 3.3 - 5 Artigo(s)
- Imprimir
- Indicar
- Estatísticas
- (0) Comentários
- Como Citar
- Download Citação
- Artigos Relacionados
- Outros dos Autores
Artigos Originais
Monitoramento laboratorial para epstein-barr vírus e citomegalovírus em pacientes submetidos ao transplante alogênico de células-tronco hematopoiéticas
Laboratory monitoring of epstein-barr virus and cytomegalovirus in patients submitted to allogeneic hematopoietic stem cell transplant
Luciana Cristina Fagundes Gequelin; Maria C. D. Rossa; Irina N. Riediger; Luine R. Vidal; Ana Perola Drulla Brandão; Alexander W. Biondo
1. Mestrado - Laboratório Central do Estado do Paraná
2. Doutorado - Laboratório Central do Estado do Paraná
3. Doutorado - Laboratório de Virologia do Hospital de Clínicas - UFPR
4. Mestranda - Universidade de São Paulo - USP
5. Doutorado - Departamento de Biologia Celular - UFPR
Laboratório Central do Estado do Paraná
São José dos Pinhais - PR, Brasil
Laboratório de Virologia do Hospital de Clínicas, Universidade Federal do Paraná, Curitiba, Brasil
Sebastiana Santana Fraga St, 1001, São José dos Pinhais
PR, Brasil. CEP: 80560-500
Resumo
As infecções virais mais comuns após transplante estão relacionadas ao Epstein-Barr vírus (EBV) e ao Citomegalovírus (CMV). O EBV está envolvido em uma complicação conhecida como desordem linfoproliferativa pós-tranplante (PTLD). E a infecção por CMV é ainda uma das grandes causas de mortalidade pós-tranplante de células-tronco hematopoiéticas (TCTH). O monitoramento dessas infecções por PCR em tempo real quantitativo (qPCR) para EBV e a antigenemia para CMV são atualmente as melhores ferramentas no manejo clínico dos pacientes imunossuprimidos. Durante o período de julho de 2009 a julho de 2010, um total de 51 pacientes foram monitorados prospectivamente. O qPCR e a antigenemia foram realizados em 601 amostras. Ao todo, 15 pacientes (29,4%) tiveram resultados detectáveis para o EBV em, pelo menos, uma amostra. Já para CMV, foram encontrados 17 pacientes (33,3%) com resultados detectáveis. É fundamental determinar a presença de infecção ativa em pacientes com imunidade comprometida para melhorar o acompanhamento e evitar complicações graves relacionadas a esses vírus.
Palavras-chave: Herpesvirus Humano 4; Citomegalovirus; Transplante de Células-Tronco Hematopoéticas
INTRODUÇÃO
O vírus Epstein-Barr (EBV), além da mononucleose infecciosa, está associado a linfomas de Hodgkin e não Hodgkin, desordem linfoproliferativa pós-transplante (PTLD), carcinoma de nasofaringe, carcinoma gástrico e outras neoplasias epiteliais1,2,3,4. Vale informar que ainda não se conhece claramente o papel do EBV em algumas doenças associadas a ele5. Após infecção inicial, o vírus permanece latente em celulas B, normalmente sem representar riscos para os indivíduos imunocompetentes. No entanto, em pacientes com imunidade comprometida, tanto a primoinfecção como a reativação ou reinfecção podem gerar graves complicações6.
A PTLD, doença de interesse no presente estudo, ocorre normalmente durante o primeiro ano pós-transplante. Não obstante, pode também acontecer mais tarde, mesmo até 10 anos após o procedimento4,7,8. Um estudo multicêntrico com 26.901 pacientes submetidos ao transplante de células-tronco hematopoiéticas (TCTH) sugeriu uma alta incidência em grupo com mais de 50 anos e submetido a um segundo transplante. Em indivíduos sem fatores de risco, a incidência foi de 0.2%. Já pacientes com um, dois ou mais fatores, o percentual foi, respectivamente, de 1.1, 3.6 e 8.1%9. Valores de DNA do EBV muitas vezes aumentam antes do aparecimento de uma lesão ou dos sintomas se tornarem evidentes, justificando o monitoramento de pacientes de com vários fatores de risco. E esse alerta precoce permite intervenção preventiva para reverter a progressão da doença10,11.
Calcula-se que cerca de 40 a 100% da população adulta já apresentou infecção primária por Citomegalovírus - CMV12. Após transplante, o CMV pode ocasionar manifestações subclínicas ou assintomáticas com resultados detectáveis na antigenemia e nos testes de reação em cadeia pela polimerase (PCR). Ou até mesmo complicações graves, interferindo no funcionamento de diversos órgãos13,14. Em vários estudos, foi mostrada a relação entre Doença do enxerto contra o hospedeiro (DECH) aguda e crônica e risco de infecção por CMV15,16,17,18. Os problemas mais freqüentes, em TCTH, relacionados ao CMV são pneumonia e complicações gastrointestinais12,19.
Vale lembrar que exames sorológicos devem ser feitos apenas com o intuito de analisar o status imunológico antes do transplante20. A antigenemia para CMV permanece como método consagrado para diagnóstico em pacientes pós-TCTH. Porém, o teste de PCR quantitativo por tempo real vem ganhando destaque devido à facilidade e tempo de execução19.
Pensando em melhorar o monitoramento de pacientes submetidos a transplantes, o estudo em questão escolheu como população alvo indivíduos que realizaram TCTH do tipo alogênico aparentado ou não aparentado. E avaliou se outros fatores, tais como sexo, doença de base, fonte de células progenitoras, são significativos para surgimento da infecção por EBV e CMV.
MATERIAL E MÉTODOS
Um estudo de coorte prospectivo foi realizado com 51 pacientes: 19 do sexo feminino e 32 do sexo masculino, e a mediana de idade de 16 anos (1 a 50 anos). Esses pacientes foram submetidos ao TCTH alogênico no Serviço de Transplante de Medula Óssea (TMO) do Hospital de Clínicas da Universidade Federal do Paraná (UFPR), Curitiba, Brasil, entre julho de 2009 e junho de 2010. Ao todo, foram coletadas 601 amostras (média de 11 amostras por paciente). Cumpre enfatizar também que o estudo foi aprovado pelo Comitê de Ética em Pesquisa em Seres Humanos do Hospital de Clínicas da Universidade Federal do Paraná sob nº CAAE 0229.0.208.000-09, CEP num. 313.EXT.019/2009-09.
O material foi coletado em tubo contendo o anticoagulante EDTA (ácido etilenodiamino tetra-acético), com capacidade para 5 ml de amostra. As coletas foram realizadas após pega do enxerto, durante o internamento e período em que os pacientes permaneceram em Curitiba.
Antigenemia para CMV
Leucócitos polimorfonucleares foram isolados a partir de sangue total coletado com EDTA. A imunofluorescencia indireta foi realizada utilizando-se o conjunto de reagentes kit CMV BriteTM Turbo de acordo com as orientações do fabricante (IQR Products, Holanda). As lâminas foram montadas com tampão de glicerina e visualizadas ao microscópio de epifluorescencia. Células com coloração nuclear foram contadas e o resultado semiquantitativo foi liberado como número de células reagentes em 200.000 leucócitos.
Extração do DNA do EBV
Após centrifugação do sangue total, o plasma foi extraído a partir de 200 µl de material na plataforma automatizada do equipamento EasyMag® (Biomerieux, Boxtel, Netherlands), eluído em 60 µl de tampão de eluição do equipamento e processado por tempo real no mesmo dia ou no dia posterior.
PCR em tempo real para EBV
Um fragmento do gene EBNA2 foi escolhido como alvo para a técnica. Os primers e sonda foram desenhados no programa Primer Express® (Applied Biosystems, Foster, CA USA), com o primer forward (5' CTA TCT TGC GTT ACA TGG GGG AC 3'), reverse (5' TGA YAG TTG TTC CTG GTA RGG ATT 3') e probe (5' FAM TGG AAA CCC GTC ACT CT MGB NFQ 3'). A reação de qPCR foi realizada em 25 µl, sendo 12,5 µl de Máster mix universal (Applied Biosystems, Foster, CA, USA), 300nM de ambos os primers, 200Nm da sonda e 5 µl do DNA extraído. Cada corrida contava com um controle negativo (água) e uma curva padrão de quatro pontos quantificada por uma curva de calibração comercial chamada OptiQuant® (Acrometrix, Benicia, CA, USA). A sensibilidade do método foi estimada em 88 cópias/ml (58-430) e o limite de detecção foi de 88 a 4.46 x 105 cópias/ml.
Equipamento De PCR em tempo real
Foi utilizado o equipamento ABI 7500 (Applied Biosystems, Foster, CA, USA) nas condições de ciclagem padrão (1 ciclo de 50°C por 2 min, 1 ciclo de 95°C por 10 min, 45 ciclos de 95°C por 15 s e de 60°C por 1 min).
Análise Estatística
As análises estatísticas foram realizadas com os Testes Exato de Fischer ou Q-quadrado do software GraphPad Prism version 3.00 for Windows, San Diego California USA, "www.graphpad.com".
RESULTADOS
As doenças de base mais prevalentes na população em estudo foram anemia aplástica severa, anemia de Fanconi, leucemia mielóide aguda e crônica.
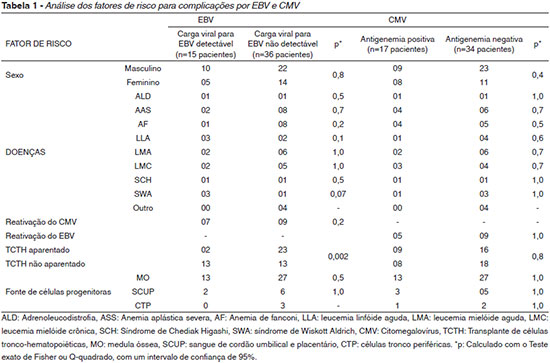
Nas 601 amostras analisadas para EBV, 532 apresentaram resultado indetectável. As 69 amostras detectáveis pertenciam a 15 pacientes diferentes. Para antigenemia, 39 amostras foram reagentes, 551 não reagentes e 11 não realizadas. Com relação aos fatores de risco para complicações por EBV e CMV, a análise multivariada teve os resultados descritos na tabela 1.
DISCUSSÃO
O ensaio para determinar a carga viral é atualmente a melhor ferramenta para detecção e quantificação do EBV, embora a confirmação laboratorial da PTLD requeira exame de biópsia e análise histológica21. Embora alguns pacientes apresentassem análise de biópsia detectável para EBV no qPCR, nenhum caso foi confirmado histologicamente para PTLD. Uma das explicações para a ausência dessa doença no Serviço de TMO é tratamento preventivo antes da instalação da PTLD com anticorpo anti-CD20 (rituximab).
Na avaliação das amostras para EBV dos 51 pacientes, 15 obtiveram resultados detectáveis (29,4%). Omar e colaboradores7 descreveram, em seu estudo, que 30% dos seus pacientes tiveram, pelo menos, uma carga viral detectável. Já Aalto e colaboradores22 encontraram um percentual menor, 14%, devido ao maior número de amostras e pacientes (5479 amostras e 406 pacientes).
Com relação aos fatores de risco para infecção/reativação do EBV, apenas o tipo de transplante foi estatisticamente significativo na analise multivariada (p < 0,05). As 13 coletas com carga viral acima de 1.000 cópias/ml pertenciam a 5 pacientes diferentes. Interessante notar que os cinco foram submetidos ao TCTH não aparentado, quatro eram menores de 17 anos e possuíam sorologia pré-transplante negativa para EBV, confirmando que altas cargas virais são encontradas com mais freqüência em pacientes jovens, submetidos ao transplante alogênico não aparentado e com infecção primária para EBV pós-transplante. Houve 56 resultados quantificados para EBV abaixo de 1.000 cópias/ml. Isso evidencia que infecções/reativações pós-transplante podem ocorrer, muitas vezes sem qualquer dano ao paciente.
Dos 51 pacientes que fizeram o teste para CMV, 17 deles (33,3%) tiveram, pelo menos, um resultado de antigenemia reagente. Ruell e colaboradores23 encontraram resultado similar, 30%, em seu estudo. Han e colaboradores24 descreveram um percentual de 39%. E outro artigo encontrou valor mais elevado: 52,2%25. Índices de reativação do CMV, na literatura, variam de 30 a 70%26.
O tratamento antiviral profilático e/ou preventivo reduz o risco de infecção por CMV e suas complicações27. Vale destacar que, na análise multivariada, nenhum fator de risco se mostrou significativo para infecção por CMV.
No presente estudo, a maior limitação foi o tamanho da amostragem. Um número maior de pacientes permitiria uma melhor análise de incidência das infecções/reativações virais e avaliação dos fatores de risco para CMV e EBV.
CONCLUSÃO
Concluiu-se com esse estudo que é fundamental determinar a presença de infecção ativa em pacientes com imunidade comprometida. Os resultados observados mostraram incidências razoavelmente altas para EBV e CMV. O acompanhamento pós-transplante facilita a decisão clínica de tratamento e evita complicações graves relacionadas aos patógenos pesquisados.
REFERÊNCIAS
1. Lima MAP, Ferreira MVP, Barros MAP, Pardini MIMC, Ferrasi AC, Rabenhorst SHB. Epstein-Barr virus-associated gastric carcinoma in Brazil: comparison between in situ hybridization and polymerase chain reaction detection. Braz. J. Microbiol.2012; 43:1.
2. Cohen JI. Epstein-Barr virus infection. New England Journal of Medicine 2000;343(7):481-92.
3. Williams H, Crawford DH. Epstein-Barr virus: the impact of scientific advances on clinical practice. Blood 2006;107(3):862-869.
4. Gulley ML, Tang W. Using Epstein-Barr viral load assays to diagnose, monitor, and prevent posttransplant lymphoproliferative disorder. Clinical Microbiology Reviews 2010;23(2):350-366.
5. Gequelin LCF, Riediger IN, Nakatani SM, Bomfim CM, Biondo AW. Epstein-Barr virus: general factors, virus-related diseases and measurement of viral load after transplant. Rev. Bras. Hematol. Hemoter. 2011;33(5):383-388.
6. Kullberg-Lindh C, Olofsson S, Brune M, Lindh M. Comparison of serum and whole blood levels of cytomegalovirus and Epstein-Barr virus DNA. Transplant Infectious Disease 2008;10(5):308-15.
7. Omar H, Hagglund H, Gustafsson-Jernberg A, Leblanc K, Mattsson J, Remberger M, et al. Targeted monitoring of patients at high risk of post-transplant lymphoproliferative disease by quantitative Epstein-Barr virus polymerase chain reaction. Transplant Infectious Disease 2009;11(5):393-9.
8. Styczynski J, Einsele H, Gil L, Ljungman P. Outcome of treatment of Epstein-Barr virus-related post-transplant lymphoproliferative disorder in hematopoietic stem cell recipients: a comprehensive review of reported cases. Transplant Infectious Disease 2009;11(5):383-92.
9. Landgren O, Gilbert ES, Rizzo JD, Socie G, Banks PM, Sobocinski KA, et al. Risk factors for lymphoproliferative disorders after allogeneic hematopoietic cell transplantation. Blood 2009;113(20):4992-5001.
10. Gulley ML, Tang W. Laboratory assays for Epstein-Barr virus-related disease. Journal of Molecular Diagnostics 2008; n. 4, p. 279-92.
11. Catalán P, Alba A. Prophylaxis against Epstein Barr disease in pediatric and adult patients undergoing solid organ and hematopoietic stem cells transplantation. Rev. chil. infectol.2012;29:1.
12. Barron MA, Gao D, Springer KL, Patterson JA, Brunvand MW, Mcsweeney PA, et al. Relationship of reconstituted adaptive and innate cytomegalovirus-specific immune responses with CMV viremia in hematopoietic stem cell transplant recipients. Clin Infect Dis. 2009;49(12):1777-83.
13. Ljungman P, Griffiths P, Paya C. Definitions of cytomegalovirus infection and disease in transplant recipients. Clin Infect Dis. 2002;34(8):1094-7.
14. Ljungman P, Hakki M, Boeckh M. Cytomegalovirus in hematopoietic stem cell transplant recipients. Hematol Oncol Clin North Am. 2011;25(1):151-69.
15. Machado CM, Menezes RX, Macedo MC, Mendes AV, Boas LS, Castelli JB, et al. Extended antigenemia surveillance and late cytomegalovirus infection after allogeneic BMT. Bone Marrow Transplant 2001;28(11):1053-9.
16. Osarogiagbon RU, Defor TE, Weisdorf MA, Erice A, Weisdorf DJ. CMV antigenemia following bone marrow transplantation: risk factors and outcomes. Biol Blood Marrow Transplant 2000;6(3):280-288.
17. Matthes-Martin S, Aberle SW, Peters C, Holter W, Popow-Kraupp T, Potschger U, et al. CMV-viraemia during allogenic bone marrow transplantation in paediatric patients: association with survival and graft-versus-host disease. Bone Marrow Transplant 1998;21 Suppl 2:S53-6.
18. Meyers JD, Flournoy N, Thomas ED. Risk factors for cytomegalovirus infection after human marrow transplantation. J Infect Dis. 1986;153(3):478-88.
19. Kuljic-Kapulica N, Stamatovic D, Savic D, Jovanovic D, Tukic L, Andjelkovic N. Monitoring of cytomegalovirus infection after allogeneic stem cell transplantation. Vojnosanit Pregl. 2010;67(5):375-8.
20. Castagnola E, Cappelli B, Erba D, Rabagliati A, Lanino E, Dini G. Cytomegalovirus infection after bone marrow transplantation in children. Hum Immunol. 2004;65(5):416-22.
21. Styczynski J, Reusser P, Einsele H, De La Camara R, Cordonnier C, Ward KN, et al. Management of HSV, VZV and EBV infections in patients with hematological malignancies and after SCT: guidelines from the Second European Conference on Infections in Leukemia. Bone Marrow Transplant 2009;43(10):757-70.
22. Aalto SM, Juvonen E, Tarkkanen J, Volin L, Haario H, Ruutu T, et al. Epstein-Barr viral load and disease prediction in a large cohort of allogeneic stem cell transplant recipients. Clin Infect Dis. 2007; 45(10):1305-9.
23. Ruell J, Barnes C, Mutton K, Foulkes B, Chang J, Cavet J, et al. Active CMV disease does not always correlate with viral load detection. Bone Marrow Transplantation 2007;40:55-61.
24. Han XY. Epidemiologic analysis of reactivated cytomegalovirus antigenemia in patients with cancer. J Clin Microbiol. 2007;45(4):1126-32.
25. Bonon AHA, Rossi CL, Souza CA, Vigorito AC, Costa SCB. Comparison of serology, antigenemia assay and the polymerase chain reaction for monitoring active cytomegalovirus infections in hematopoietic stem cell transplantation. Rev. Inst. Med. trop. S. Paulo 2006;48:5.
26. Asano-Mori Y, et al. High-grade cytomegalovirus antigenemia after hematopoietic stem cell transplantation. Bone Marrow Transplantation 2005;36(9):813-9.
27. Hebart H, AND Einsele H. Clinical Aspects of CMV Infection After Stem Cell Transplantation. Human Immunology 2004;65:432-436.