Número: 11.11 - 8 Artigo(s)
- Imprimir
- Indicar
- Estatísticas
- (0) Comentários
- Como Citar
- Download Citação
- Artigos Relacionados
- Outros dos Autores
Artigos Originais http://www.dx.doi.org/10.5935/2674-7960.v11-0003
Tratamento com daptomicina em infecção da corrente sanguínea por Enterococcus resistente a vancomicina em paciente com câncer de cólon: desfecho óbito
Treatment with daptomycin for bloodstream infection with vancomycin-resistant Enterococcus in a patient with colon cancer: death outcome
Cynthia Regina Pedrosa Soares1; Vera Magalhães2; Paulo Sérgio Ramos de Araújo3
Recebido em 06/02/2023
Aceito em 31/05/2023
Resumo
INTRODUÇÃO: Infecção da corrente sanguínea (BSI) por Enterococcus Resistente à Vancomicina (VRE) é uma complicação grave associada à colangite bacterêmica em pacientes com tumor sólido.
OBJETIVO: Descrever o aspecto clínico e molecular do isolado Enterococcus Resistente à Vancomicina em paciente com tumor de cólon.
MÉTODOS: O isolado de VRE foi identificado e analisado quanto ao perfil antimicrobiano a partir de hemocultura processada por método automatizado Vitek, posteriormente foi submetida à detecção do gene de Resistência à Vancomicina, vanA.
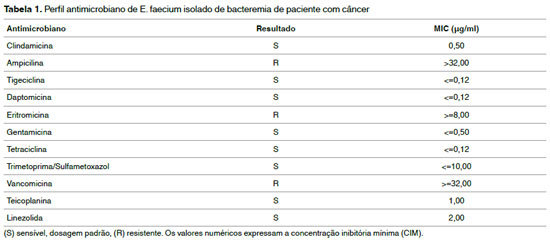
RESULTADO: O isolado Enterococcus faecium apresentou resistência à amicacina, eritromicina e vancomicina. O gene VanA foi identificado e iniciado o tratamento com teicoplanina seguida de daptomicina sem sucesso a paciente evoluiu a óbito.
Palavras-chave: Enterococcus faecium; Resistência a Vancomicina; Daptomicina; Bacteriemia; Neoplasias do Colo.
INTRODUÇÃO
Enterococcus faecium tem sido classificado como o segundo mais importante patógeno nosocomial em todo o mundo (1). Infecção da corrente sanguínea (BSI) por Enterococcus Resistente à Vancomicina (VRE) é uma complicação grave em populações imunocomprometidas (2). VRE tem sido uma das principais causas de infecção na corrente sanguínea após transplante de células-tronco hematopoiéticas (3). Além disso, Enterococcus faecium Resistente à Vancomicina tem sido comum em pacientes com malignidades hematológicas (4) e tumor sólido (5). E. faecium tem sido associado a colangite bacterêmica em pacientes com tumor sólido (6).
A incidência de E. faecium portadores do gene vanA varia de 25%(7) a 72,7%(8).
Estudos demonstraram que o uso de dispositivos de acesso venoso central, neutropenia, transplante hematopoiético alogênico, cateterismo urinário e duração da terapia com metronidazol foram fatores de risco(9,10).
Aqui demonstramos uma infecção na corrente sanguínea por Entecococcus faecium Resistente à Vancomicina abrigando o gene VanA, a caracterização do perfil de resistência do isolado, o tratamento e no desfecho clínico em infecção na corrente sanguínea de paciente com tumor sólido.
RELATO DE CASO
Uma mulher de 77 anos, nascida em Pernambuco, Brasil, foi admitida dia 13 de janeiro de 2020, relatando alguns sintomas, tais como, perda de peso, tosse seca, anemia, cólica, disfagia, dor no estômago e azia. Diagnosticada com câncer de cólon ascendente, paciente foi submetida a uma biópsia da lesão ulcerada em cólon ascendente, evidenciando um carcinoma mal diferenciado com ampla infiltração de mucos, com ulceração e com permeação para vaso linfático. Paciente realizou uma ressecção alargada do tumor de intestino (colectomia) e uma laparotomia explorada nos dias 16 e 24 de janeiro respectivamente. Durante a sua internação a paciente foi encaminhada para Unidade de Terapia Intensiva (UTI) fez ventilação mecânica, traqueostomia, fez uso de droga sedativa (midazolan e fentanil) e droga vasoativa (noradrenalina). A paciente fazia uso dos dispositivos, cateter venoso central e periférico, sonda vesical de demora (SVD) e dispositivo tubo orotraqueal (TOT). A cultura de líquido ascítico evidenciou Candida spp coletada dia 25/01, swab retal foi negativo. Paciente foi tratada com anidulafungina 100 mg + 100 ml SF EV 24/24h em 1H DO por 15 dias. A paciente desenvolveu um quadro de bacteremia no dia sete de fevereiro por Enterococcus spp Resistente à Vancomicina. O teste de suscetibilidade mostrou resistência também à ampicilina e eritromicina (Tabela 1). Foram realizados outros testes para a confirmação, tais como teste de identificação e antibiograma por testes bioquímicos automatizados e cartões Vitek GPI e teste molecular para a detecção do gene VanA. A paciente teve um episódio de febre, apresentando neutropenia, com neutrófilos 89,2/ mm3, contagem de leucócitos de 17570/mm3, hemoglobina de 9,5 g/dL e plaquetas 83.000/mm3, no qual realizou transfusão de hemocomponentes. Iniciou terapia com teicoplanina (400 mg +100 ml EV 24/24 h em 1H DO) por 15 dias. A daptomicina (500 mg + 100 ml SF0,9% 24/24h foi administrada no dia 13/02 por um período de 10 dias. Os testes automatizado e molecular revelaram E. faecium Resistente à Vancominica codificando o gene VanA. A paciente não obteve melhora clínica, desenvolvendo choque séptico, evoluindo para óbito no dia 22/02/20 com 39 dias de internamento.
Pesquisa do Gene dee Resistência à Vancomicina
O DNA genômico foi isolado usando o kit Relia Prep mini kit (Promega) de acordo com as instruções do fabricante. O gene de resistência VanA foi obtido através da Reação em Cadeia de Polimerase (PCR) utilizando os primers VanA-F (5’- CATGACGTAATCGGTAAAATC-3’) e VanA-R (5’- ACCGGGCAGRGTATTGAC-3’) com tamanho de fragmento de 732 pb. O protocolo de PCR usado na reação foi o kit de reagente PCR Master Mix TopTaq (Qiagen). A reação volume total, 25 µl) consiste de: Master Mix (10x PCR buffer, 15 mM MgCl2, 200µM de cada dNTP e 1,25 U TopTaq DNA polimerase) 10 µM de cada primer. A PCR foi realizada usando o instrumento B-raid (USA). As condições de reação foram: pré-desnaturação a 94°C por três min, seguida de 35 ciclos de amplificações de 94°C por 30s, 60°C por 30s, 72°C por um min, com uma extensão final de 72°C por 10 min (Figura 1).
DISCUSSÃO
Este estudo descreve as características microbiológicas, epidemiológicas e molecular de um isolado clínico de VRE obtido de infecção na corrente sanguínea de paciente com câncer em um hospital de referência no Estado de Pernambuco, Brasil. Durante a internação para tratar o tumor de cólon, a paciente adquiriu infecção fungica por Candida spp do fluido peritoneal, tratada com sucesso com anidulafungina. Em seguida a paciente desenvolveu infecção na corrente sanguínea por Enterococcus faecium resistente à amipicila, eritromicina e vancomicina. Apesar de fazer parte da microbiota intestinal, Enterococcus resistentes à vancomicina podem expandir-se rapidamente para regiões mais densas no trato gastrointestinal, persistindo por dias após a interrupção da administração de antibióticos(11), a translocação bacteriana é favorecida pelo aumento na permeabilidade da mucosa do cólon lesado e atua como fator de risco para bacteremia(12), isso justifica a cultura de swab retal ter sido negativa, apesar do resultado positivo da hemocultura.
A resistência à vancomicina pela cepa Enterococcus foi confirmada pelo genótipo que abrigava a variante VanA, classificada como a variante mais frequentemente encontrada em E. faecium(13,14).
Daptomicina foi administrado para o tratamento de bacteremia sem êxito. Pacientes que receberam daptomicina como tratamento de infecção contra VRE tiveram uma taxa de letalidade de 33%(15). Tratamento infecções da corrente sanguínea por Staphylococcus aureus com daptomicina em infecções de pele e tecidos moles tem sido amplamente utilizado. No entanto, a eficácia da daptomicina no tratamento da ICS em Enterococcus resistente à vancomicina ainda não está bem estabelecida(15). Embora o tratamento mais indicado para VRE seja linezolida, teicoplanina ou daptomicina(16,17). Linezolida tem sido associada a um risco significativamente maior de falha do tratamento e letalidade em comparação com a daptomicina(18). Em contrapartida, pacientes tratados com daptomicina têm sido associados a maior mortalidade em 14 e 28 dias e menores taxas de erradicação microbiana do que os pacientes tratados com linezolida(19). Estudos apontam que a daptomicina mostram resultados comparáveis com linezolida, no entanto, altas doses devem ser consideradas para pacientes com bacteremia VRE(20).
Diante disso, estudos mostram que além de antibióticos, comensais produtores de lantibióticos do trato gastrointestinal podem reduzir a colonização por VRE ou a utilização de cepas Blautia producta e Clostridium bolteae para restaura a resistência de colonização contra VRE(21,22). O uso de bactérias probióticas comensais no transplante fecal tem sido utilizado como estratégias contra VRE.
Maior gravidade da doença e tratamento inadequado têm sido associados com aumento da mortalidade(19). Tem sido documentado uma tendência de aumento da mortalidade para aqueles tratados com daptomicina(17,18,19).
Enterococcus resistentes à vancomicina representam uma séria ameaça ao público em geral, especialmente aos pacientes hospitalizados com câncer, elevando a taxa de mortalidade. O tumor de cólon ascendente pode ter sido um predisponente para a infecção e o agravo do desfecho. A vigilância de microrganismos e resistência aos antimicrobianos é crucial para reduzir a mortalidade.
Autores e Colaboradores
CS: Responsável pela conceitualização e curadoria de dados abrangentes de pesquisa, VM: Administração do projeto, responsável pelo gerenciamento e coordenação da atividade de pesquisa. PSA: Supervisão, responsabilidade de supervisão e liderança pelo planejamento e execução da atividade de pesquisa, incluindo orientação externa à equipe principal.
Aprovação Ética
Este trabalho foi aprovado pelo Comitê de Ética em Pesquisas do Hospital do Câncer de Pernambuco (HCP) em que o trabalho foi realizado (CAEE: 16285219.5.0000.5205).
REFERÊNCIAS
1. Kolonen A, Sinisalo M, Huttunen R, Syrjänen J, Aittoniemi J, Huhtala H, et al. Bloodstream infections in acute myeloid leukemia patients treated according to the Finnish Leukemia Group AML-2003 protocol - a prospective nationwide study. Infect Dis (Lond). 2017; 49(11-12):799-808. doi: 10.1080/23744235.2017.1347814.
2. Xie O, Slavin MA, Teh BW, Bajel A, Douglas AP, Worth LJ. Epidemiology, treatment and outcomes of bloodstream infection due to vancomycin-resistant enterococci in cancer patients in a vanB endemic setting. BMC Infect Dis. 2020; 18:20(1):228. doi: 10.1186/s12879-020-04952-5.
3. Kamboj M, Cohen N, Huang YT et al. Impact of Empiric Treatment for Vancomycin-Resistant Enterococcus in Colonized Patients Early after Allogeneic Hematopoietic Stem Cell Transplantation. Biol Blood Marrow Transplant. 2019; 25(3):594-598. doi: 10.1016/j.bbmt.2018.11.008.
4. Alatorre-Fernández P, Mayoral-Terán C, Velázquez-Acosta C, Franco-Rodríguez C, Flores-Moreno K, Cevallos MÁ, et al. A polyclonal outbreak of bloodstream infections by Enterococcus faecium in patients with hematologic malignancies. Am J Infect Control. 2017; 1:45(3):260-266. doi: 10.1016/j.ajic.2016.10.002.
5. Teng JC, Lingaratnam SM, Trubiano JA, Thursky KA, Slavin MA, Worth LJ. Oral pristinamycin for the treatment of resistant Gram-positive infections in patients with cancer: Evaluation of clinical outcomes. Int J Antimicrob Agents. 2016; 47(5):391-6. doi: 10.1016/j.ijantimicag.2016.01.017.
6. Royo-Cebrecos C, Gudiol C, García J, Tubau F, Laporte J, Ardanuy C, et al. Characteristics, aetiology, antimicrobial resistance and outcomes of bacteraemic cholangitis in patients with solid tumours: A prospective cohort study. J Infect. 2017; 74(2):172-178. doi: 10.1016/j.jinf.2016.10.008.
7. Krull M, Klare I, Ross B, Trenschel R, Beelen DW, Todt D, et al.Emergence of linezolid- and vancomycin-resistant Enterococcus faecium in a department for hematologic stem cell transplantation. Antimicrob Resist Infect Control. 2016; 22:5-31. doi: 10.1186/s13756-016-0131-6.
8. Papadimitriou-Olivgeris M, Kolonitsiou F, Karamouzos V. Molecular characteristics and predictors of mortality among Gram-positive bacteria isolated from bloodstream infections in critically ill patients during a 5-year period (2012-2016). Eur J ClinMicrobiol Infect Dis. 2020; 2. doi: 10.1007/s10096-019-03803-9.
9. Cheah AL, Peel T, Howden BP, Spelman D, Grayson ML, Nation RL, et al. Estudo caso-caso-controle sobre fatores associados à bacteremia enterocócica resistente à vancomicina e suscetível à vancomicina. BMC Infect Dis. 2014; 14:353.
10. Peel T, Cheng AC, Spelman T, Huysmans M, Spelman D. Diferentes fatores de risco para bacteremia enterocócica resistente à vancomicina e sensível à vancomicina. Clin Microbiol Infect. 2012; 18(4):388-94.
11. Taur Y, Xavier JB, Lipuma L, Ubeda C, Goldberg J, Gobourne A, et al. Dominação intestinal e risco de bacteremia em pacientes submetidos a transplante alogênico de células-tronco hematopoiéticas . Clinical Clin Infect Dis 2012; 55:905-914. doi: 10.1093 / cid / cis580.
12. Amarnani R, Rapose A. Colon cancer and enterococcus bacteremia co-affection: A dangerous alliance. J Infect Public Health. 2017; 10(5):681-684. doi: 10.1016/j.jiph.2016.09.009.
13. Bender JK, Cattoir V, Hegstad K, Sadowy E, Coque TM, Westh H, et al. Update on prevalence and mechanisms of resistance to linezolid, tigecycline and daptomycin in enterococci in Europe: Towards a common nomenclature. Drug Resist Updat. 2018; 40:25-39. doi: 10.1016/j.drup.2018.10.002.
14. Lochan H, Moodley C, Rip D, Bamford C, Hendricks M, Davidson A, Eley B. Emergence of vancomycin-resistant Enterococcus at a tertiary paediatric hospital in South Africa. S Afr Med J. 2016; 9:106(6):39-43. doi: 10.7196/SAMJ.2016.v106i6.10858.
15. Poutsiaka DD, Skiffington S, Miller KB, Hadley S, Snydman DR. Daptomycin in the treatment of vancomycin-resistant Enterococcus faecium bacteremia in neutropenic patients. J Infect. 2007; 54(6):567-71. doi: 10.1016/j.jinf.2006.11.007.
16. Büyükcam A, Karadag Öncel E, Özsürekçi Y, Cengiz AB, Kuskonmaz B, Sancak B. Vancomycin-resistant Enterococcus bacteremia in a child with acute myeloid leukemia: successful treatment with daptomycin. Arch Argent Pediatr. 2016; 1;114(6):e432-e435. English, Spanish. doi: 10.5546/aap.2016.eng.e432.
17. Narayanan N, Rai R, Vaidya P, Desai A, Bhowmick T, Weinstein MP. Comparison of linezolid and daptomycin for the treatment of vancomycin-resistant enterococcal bacteremia. Ther Adv Infect Dis. 2019; 13;6:2049936119828964. doi: 10.1177/2049936119828964.
18. Britt NS, Potter EM, Patel N, Steed ME. Comparison of the Effectiveness and Safety of Linezolid and Daptomycin in Vancomycin-Resistant Enterococcal Bloodstream Infection: A National Cohort Study of Veterans Affairs Patients. Clin Infect Dis. 2015; 15;61(6):871-8. doi: 10.1093/cid/civ444. Epub 2015 Jun 10.
19. Ye JJ, Shie SS, Cheng CW, Yang JH, Huang PY, Wu TS, et al. Clinical characteristics and treatment outcomes of vancomycin-resistant Enterococcus faecium bacteremia. J Microbiol Immunol Infect. 2018; 51(6):705-716. doi: 10.1016/j.jmii.2017.08.025.
20. Shi C, Jin W, Xie Y, Zhou D, Xu S, Li Q, Lin N. Efficacy and safety of daptomycin versus linezolid treatment in patients with vancomycin-resistant enterococcal bacteraemia: An updated systematic review and meta-analysis. J Glob Antimicrob Resist. 2020; 21:235-245. doi: 10.1016/j.jgar.2019.10.008.
21. Kim SG, Becattini S, Moody TU, Shliaha PV, Littmann ER, Seok R, et al. Microbiota-derived lantibiotic restores resistance against vancomycin-resistant Enterococcus. Nature. 2019; 572(7771):665-669. doi: 10.1038/s41586-019-1501-z.
22. Caballero S, Kim S, Carter RA, Leiner IM, Susac B, Miller L, et al. Cooperating Commensals Restore Colonization Resistance to Vancomycin-Resistant Enterococcus faecium. Cell Host Microbe. 2017; 10;21(5):592-602.e4. doi: 10.1016/j.chom.2017.04.002.