Número: 6.6 - 5 Artigo(s)
- Imprimir
- Indicar
- Estatísticas
- (0) Comentários
- Como Citar
- Download Citação
- Artigos Relacionados
- Outros dos Autores
Artigos Originais
Avaliação da contaminação extrínseca de sabonete líquido utilizado para lavagem das mãos em um hospital filantrópico
Evaluation of extrinsic contamination of liquid soap used for handwashing in a philanthropic hospital
Elisa Alves Cunha1; Juliana Alves Vargas1; Leandro Oliveira de Morais1; Patrícia Guedes Garcia2
1. Alunos do Programa de Pós-Graduação Latu Senso em Análises Clínicas da Faculdade de Ciências Médicas e da Saúde de Juiz de Fora- SUPREMA
2. Professora do Programa de Pós-Graduação Latu Senso em Análises Clínicas da Faculdade de Ciências Médicas e da Saúde de Juiz de Fora- SUPREMA
Leandro Oliveira de Morais
Rua Senador Salgado Filho, 415/403 – Bom Pastor
Juiz de Fora - MG
E-mail: leandroomorais@hotmail.com
Resumo
INTRODUÇÃO: As Infecções Relacionadas à Assistência à Saúde representam um problema de saúde pública, e são causadas por diversos microrganismos. Como forma de prevenção a de higienizar das mãos se mostra como uma grande medida, porém os sabonetes e anti-sépticos utilizados durante esse processo podem ser um importante veículo de contaminação, que pode ocorrer durante o processo de fabricação ou durante seu uso.
OBJETIVO: Avaliar a contaminação extrínseca por bactérias patogênicas de sabonetes líquidos utilizados por profissionais de saúde em um hospital filantrópico.
MATERIAIS E MÉTODOS: Foram coletadas 64 amostras, 32 pushs de dispensação do sabonete, através de Swabs estéreis e 32 sabonetes líquidos. As amostras foram inoculadas em caldo BHI, incubadas por 24/48 horas, em estufa de aerobiose, à 35ºC. Foram repicadas em Ágar MacConkey e Ágar Sangue e incubadas por 24/48 horas, em aerobiose, a 35º ± 1ºC. As colônias presentes nos meios de cultura foram identificadas por provas bioquímicas e fisiológicas e submetidas ao teste de sensibilidade aos antimicrobianos.
RESULTADOS: Das 64 amostras coletadas, em 25 (39,06%) houve crescimento de bactérias, sendo 14 (21,87%) pushs de dispensação e 11 (17,19%) em sabonetes, 28 cepas foram identificadas com prevalência de 12 cepas (42,85%) de Acinetobacter spp, 4 (14,28%) de Enterobacter cloacae, 3 (10,72%) de Klebsiella oxytoca, 3 (10,72%) de Pantoea spp., 3 (10,72%) de Pseudomonas spp., 2 (7,14%) de Escherichia coli, e 1 (3,57%) de Klebsiella pneumoniae.
CONCLUSÃO: Houve contaminação extrínseca dos sabonetes líquidos por bactérias patogênicas.
Palavras-chave: Higienização das mãos, Sabões, Contaminação, Infecções Relacionadas à Assistência à Saúde.
INTRODUÇÃO
As Infecções Relacionadas à Assistência à Saúde (IRAS) referem-se àquelas adquiridas durante a prestação dos cuidados de saúde, após admissão do paciente, durante a internação ou após a alta1. Representam um importante problema de saúde pública, tanto nos países desenvolvidos como em países em desenvolvimento, pois aumentam as taxas de morbidade e de mortalidade, prolongam o período de internação e elevam os custos hospitalares1,2.
Apesar dos importantes avanços alcançados no controle das infecções, estudos demonstram a emergência do problema globalmente, pelo aumento acentuado da frequência e da gravidade dos casos de IRAS3,4. Nos Estados Unidos, mais de 70% das bactérias isoladas nos hospitais são resistentes a pelo menos um antimicrobiano de uso comum no tratamento da infecção5. A aquisição de microrganismos resistentes ocorre, geralmente, pelo fato da não adesão dos profissionais às medidas de biossegurança, a sobrecarga de trabalho, por vezes, o número reduzido de recursos humanos e o contato direto do paciente com ambiente ou material contaminado4,5.
Atualmente, acredita-se que uma proporção considerável das IRAS podem ser evitadas, sendo a higienização das mãos ainda bastante importante neste contexto por ser uma medida de inquestionável eficácia e baixo custo, pois os microrganismos mais associados à ocorrência de tais infecções são pertencentes à microbiota transitória (adquirida através dos contatos estabelecidos com pessoas colonizadas ou infectadas e/ou com objetos contaminados)6. Esses microrganismos podem ser eliminados através da higienização das mãos, sendo que, quando não realizada ou se realizada de forma inadequada, constitui uma premissa básica para ocorrência de transmissão cruzada6,7.
A higienização das mãos juntamente com a correta técnica, deve fazer parte da rotina dos profissionais de saúde. Estudos bem conduzidos têm mostrado a importância da referida prática na redução das taxas de IRAS e a maioria dos especialistas em controle de infecções afirma que esse procedimento é o meio mais simples e eficaz de prevenir a transmissão de microrganismos no ambiente assistencial8,9.
A limpeza das mãos com água e sabão elimina os microrganismos transitórios e reduz os residentes e, na maioria das vezes, interrompe a cadeia de transmissão de doenças. Como uma forma de prevenir infecções a ação de higienizar as mãos se mostra como uma grande medida, mas é importante lembrar que os sabonetes e anti-sépticos utilizados durante esse processo podem ser um importante veículo de contaminação, contaminação essa que pode ocorrer durante o processo de fabricação (contaminação intrínseca) ou durante seu uso (contaminação extrínseca)10,11.
Diante dessas considerações, este estudo teve como objetivo avaliar a contaminação extrínseca por bactérias patogênicas de sabonetes líquidos utilizado durante o processo de lavagem das mãos dos profissionais de saúde em um hospital filantrópico.
MÉTODOS
O desenho adotado neste estudo foi descritivo transversal, onde avaliamos a presença da contaminação extrínseca de sabonetes líquidos utilizados em um hospital filantrópico.
As amostras foram coletadas nos meses de agosto e setembro de 2016, de saboneteiras de plástico, fixadas na parede, com refil para reabastecimento e pushs de dispensação do sabonete. Com swab estéril com meio Stuart (Labor® Swab) foram coletada a amostra do pushs e em tubo de ensaio foram recolhido 1 ml do sabonete líquido. Após a coleta, as amostras foram encaminhadas ao laboratório de microbiologia da Faculdade de Ciências Médicas e da Saúde de Juiz de Fora.
As amostras foram inoculadas em caldo BHI (Mbiolog diagnósticos Ltda. ®), incubadas por 48 horas em estufa de aerobiose, (Fanem® 502 São Paulo - Brasil), a 35ºC ± 1. Após este período de incubação foram repicadas em Ágar Sangue 5% (RenyLab®, Química e Farmacêutica) e Ágar MacConkey (RenyLab®, Química e Farmacêutica), incubadas por 24-48 horas, em aerobiose, a 35º ± 1ºC e realizadas as provas bioquímicas para a identificação de cada espécie12,13. Para identificação dos bastonetes Gram-negativos foram utilizados prova do OF, IAL, citrato, arginina, ornitina, lisina, motilidade, oxidase e resistência a polimixina B12,13.
As bactérias identificadas foram submetidas ao teste de sensibilidade aos antimicrobianos (TSA) pelo método de Ágar Difusão em Disco, de acordo com a padronização do CLSI 2016 - Clinical Laboratory Standards Institute14.
Para família Enterobacteriaceae foram testados os seguintes antimicrobianos: amoxicilina + clavulanato, ceftazidima, ceftriaxona, cefepime, aztreonam, ertapenem, meropenem, imipenem, gentamicina, amicacina, sulfametoxazol + trimetoprin, ciprofloxacina e levofloxacin.
Para Acinetobacter spp., foram testados: ceftazidima, ceftriaxona, cefepime, meropenem, imipenem, gentamicina, amicacina, sulfametoxazol + trimetoprin, levofloxacin, ciprofloxacina, ampicilina + sulbactam e tetraciclina. E para Pseudomonas spp., foram testados: piperacilina + tazobactam, caftazidima, cefepime, aztreonam, gentamicina, imipenem, meropenem, amicacina, levofloxacin, ciprofloxacina.
RESULTADOS
Foram analisadas 32 saboneteiras, totalizando 64 amostras, sendo 32 pushs de dispensação do sabonete e 32 sabonetes líquidos utilizados em diferentes setores do hospital, sendo divididos em Unidade de Terapia Intensiva 1 - UTI1 (14 amostras), Unidade de Terapia Intensiva Neonatal - UTINEO (10 amostras), Unidade de Terapia Intensiva 2 - UTI2 (12 amostras), Sala de Recepção da Unidade de Terapia Intensiva 1 - SRUTI1 (4 amostras), Centro Cirúrgico - CC (4 amostras), Centro de Parto Normal - CPN (4 amostras), Unidade de Internação 5 - UINT5 (4 amostras), Unidade de Internação 6 -UINT6 (8 amostras) e no Refeitório - REF (4 amostras).
Das 64 amostras coletadas, em 25 (39,09%) houve crescimento de bactérias, sendo 14 (21,87%) nos pushs de dispensação e 11 (17,19%) em sabonetes. A porcentagem de crescimento microbiano de acordo com o local amostrado está descrita no gráfico 1. Em 4,68% das amostras houve crescimento de mais de uma espécie bacteriana.
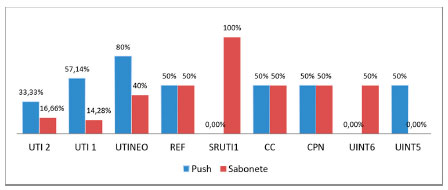
Gráfico 1. Porcentagem de crescimento microbiano nos pushs de dispensação e sabonetes líquidos, distribuídos por setores do hospital.
Com relação aos microrganismos encontrados, dentre as 25 amostras positivas de pushs de dispensação e de sabonetes, 28 cepas foram identificadas, sendo 12 cepas (42,85%) de Acinetobacter spp, 4 (14,28%) de Enterobacter cloacae, 3 (10,72%) de Klebsiella oxytoca, 3 (10,72%) de Pantoea spp., 3 (10,72%) de Pseudomonas spp., 2 (7,14%) de Escherichia coli, e 1 (3,57%) de Klebsiella pneumoniae como está descrito no gráfico 2.
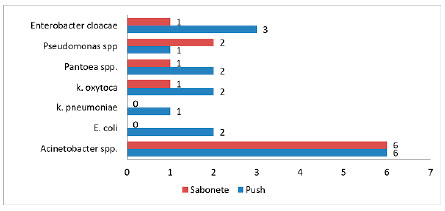
Gráfico 2. Distribuição do número de espécies bacterianas encontradas nos pushs de dispensação e sabonetes de um hospital filantrópico.
Na UTI1, 60,0% das amostras positivas foram de Acinetobacter spp. e 40,0% de E. coli. Na UTINEO a prevalência foi de 50,0% de Acinetobacter spp., 33,33% de Pantoea spp. e 16,67% de K. pneumoniae. Na UTI2 o crescimento foi de 100,0% de Acinetobacter spp, e no CPN foi de 50,0% de Pseudomonas spp. e 50,0% de E. cloacae. No SRUTI1 foi de 100,0% de Acinetobacter spp. e no REF foi de 100,0% de Pseudomonas spp.. Na INT5 foi de 50,0% de K. oxytoca e 50,0% de E. cloacae, e na INT6 foi de 50,0% de Acinetobacter spp. e 50% de Pantoa spp.. No CC foi de 50,0% de E. cloacae e 50,0% de K. oxytoca, conforme tabela 1.
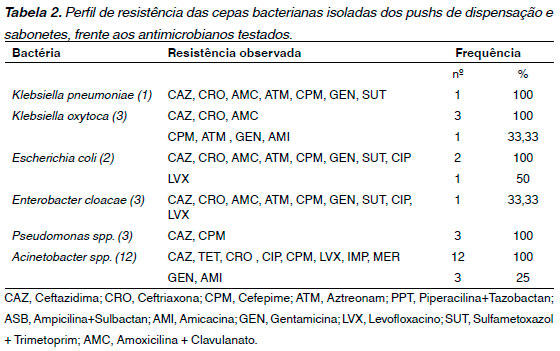
Foi realizado o Teste de Sensibilidade aos Antimicrobianos (TSA), para avaliar o perfil de resistência das bactérias encontradas. Os antimicrobianos testados foram de acordo com a padronização do CLSI 2016, e o perfil de resistência observado está relatado na tabela 2.
Através de testes fenotípicos foi verificado que as cepas E. coli (2), K. oxytoca (1), K. pneumoniae (1) e E. cloacae (1), foram produtoras de betalactamase de amplo espectro (ESBL), e as cepas de Pseudomonas sp. (3) foram produtoras de betalactamase do tipo AmpC.
DISCUSSÃO
A maioria dos ambientes estão suscetíveis à contaminação por microrganismos diretamente relacionados com a situação higiênica local. Consequentemente, objetos de uso rotineiro e com higienização inadequada podem se tornar focos de contaminação e infecção em hospedeiros suscetíveis. A sobrevivência de microrganismos no ambiente varia em diferentes tipos de superfícies, podendo ser de alguns minutos até meses. Quanto maior o tempo em que um microrganismo persiste viável em uma superfície, maior o tempo que ele se mantém como fonte de transmissão, elevando a chance de transferência a um hospedeiro15.
Uma questão central na prevenção e controle de infecções é a importância da lavagem das mãos como o principal esforço dos profissionais de saúde para prevenção e propagação de doenças infecciosas no cenário clínico16,17. No entanto, o sabão líquido pode tornar-se contaminado com bactérias e representar um risco reconhecido para a saúde em cenários de cuidados de saúde16, 18. Em particular, os dispensadores de sabão-reutilizáveis são propensos à contaminação bacteriana e vários surtos ligados ao uso de sabão contaminado em ambientes de cuidados de saúde foram relatados10, 16, 18-21.
Os fabricantes fornecem instruções para o uso da lavagem das mãos, mas tipicamente não fornecem instruções para recarregar os dispensadores. Tais instruções seriam benéficas porque os sabões liquídos são comprados em galões para recarregar os dispensadores18. Além disso, quando as bombas reutilizáveis são fornecidas e transferidas entre várias garrafas, a contaminação cruzada é uma preocupação. A observação regular das datas de expiração é importante porque os agentes ativos ou conservantes podem se degradar ao longo do tempo, o que pode reduzir a eficácia do sabão contra os microrganismo18, 22.
Os sistemas abertos de dispensação, conforme a prática utilizada na instituição do presente estudo, e a manipulação dos sabões líquidos no ambiente hospitalar são fatores conhecidos de riscos para a contaminação microbiana desses produtos10. Alguns estudos fazem recomendações para evitar que o sabão se torne fonte de infecção, como comprar dispensadores descartáveis, usar garrafas de sabonetes com volume menor, limitar o uso de sabão líquido, fornecer sabão individual para os pacientes e aumentar a desinfecção com álcool gel10,23.
Embora as instalações possam ter protocolos de limpeza documentados para dispensadores de sabão líquido, o não cumprimento pode ser um problema que leva à contaminação. Vários estudos investigaram a contaminação microbiana de sabões líquidos em ambientes hospitalares e comunitários. Uma série de patógenos bacterianos oportunistas foram recuperados de sabonetes líquidos, incluindo Klebsiella pneumoniae, Serratia marcescens, Staphylococcus aureus resistente à meticilina (MRSA), Pseudomonas sp. e Enterobacter spp.16,20.
No presente estudo, verificou-se que 39,06% das amostras estavam contaminadas. Foram encontradas 12 cepas de Acinetobacter spp., principal patógeno identificado. O Acinetobacter spp., tem sido responsável por causar diferentes tipos de infecções, como pneumonias, septicemias, infecções urinárias e meningites, especialmente em pacientes imunocomprometidos, sendo considerado um patógeno oportunista de grande importância nas IRAS24. Durante a última década, o tratamento dessas infecções tem se tornado crítico, em função do surgimento de cepas multirresistentes cuja disseminação tem sido associada à contaminação de equipamentos hospitalares (respiradores, ar condicionado, equipamentos para diagnóstico por imagem, etc.) e/ou através das mãos contaminadas da equipe assistencial24, 25.
Pseudomonas spp. é um microrganismo ubíquo encontrados facilmente em todo ambiente hospitalar, sendo um importante agente causador de IRAS frequentemente identificado como agente causal de infecção pela habilidade que possui de sobreviver em locais de umidade elevada como pias e aparelhos de respiração como mascaras de ventilação26. Quase todos os equipamentos e materiais hospitalares, principalmente com componentes líquidos, podem servir de reservatório para Pseudomonas spp. incluindo equipamentos de ventilação respiratória, de terapia intravenosa e até alguns germicidas como sabonete líquido e desinfetantes10,26. A resistência intrínseca a multiplos antimicrobianos contribui para o caráter oportunista desse patógeno26,27. Foi detectado neste estudo, que 100% (3) das cepas de Pseudomonas sp. foram produtoras de betalactamase do tipo AmpC, enzima que confere resistência a cefalosporinas e penicilinas.
Foi observado o crescimento de cepas da família Enterobacteriaceae, 5 foram produtoras de ESBL, sendo E. coli (2), K. oxytoca (1), K. pneumoniae (1) e E. cloacae (1). A produção de ESBL por enterobactérias tem um importante impacto nas taxas de morbidade e até mortalidade bem como nos custos de tratamento hospitalar e comunitário28-30. A produção de ESBL é um importante mecanismo de resistência em enterobactérias29. O tratamento de infecções causadas por cepas produtoras de ESBL oferece um substancial desafio à terapia antimicrobiana, pois as ESBLs são capazes de hidrolisar penicilinas, cefalosporinas de todas as gerações e monobactâmicos, minimizando as opções terapêuticas29-33. Aliado a isso, o uso contínuo e, muitas vezes inadequado, de agentes antimicrobianos pode induzir à seleção de cepas multirresistentes29,34.
Nesse estudo, observou-se o crescimento de Pantoea spp. em dispensadores e sabão, com prevalência de 3 cepas, que não apresentaram resistência aos antimicrobianos testados. A Pantoea spp. é um importante patógeno de plantas, mas que pode causar doença em casos raros e já foi encontrado em feridas, sangue e urina, como patógeno oportunista e já foi responsável por vários surtos de septicemia de âmbito nacional nos EUA12,35. Em meados dos anos 1960 a Pantoea agglomerans foi identificada em IRAS, sendo a espécie mais frequente associados com infecções humanas36,37. Surtos hospitalares devido à contaminação do anestésico propofol, produtos derivados do sangue, nutrição parenteral, e tubos de transferência utilizados para hidratação intravenosa já foram relatados35-38.
P. agglomerans é agente causador da infecção em crianças e idosos e pode causar bacteriemia, muitas vezes em associação com agentes patogênicos mais convencionais, sendo responsável também por surtos em UTINEO35,36,38,39. Nos últimos anos tem sido relatado um aumento notável nas IRAS, especialmente nas UTINEO, unidades de cuidados intensivos e oncologia. Doenças de base, baixo peso ao nascer, sistema imunológico imunocomprometido, quimioterapia, e uso de dispositivos invasivos podem ser fatores predisponentes em casos de infecções causadas por microorganismos não usuais, incluindo P.agglomerans36,37.
Diante dessa considerações, este estudo avaliou a contaminação extrínseca de sabonetes líquidos utilizado em um hospital filantrópico, pois, a nosso ver, estudos desta natureza auxiliam na prevenção de infecção e, consequentemente, na redução de suas taxas e de seus custos. Desse modo, acarretam benefícios para a instituição e para o paciente que não terá seu estado de saúde comprometido nem a sua permanência prolongada no hospital em decorrência de uma IRAS. Embora não se possa afirmar aqui que tenham influenciado nas taxas de infecções, uma vez que não foi estabelecido a relação causal, algumas bactérias são agentes conhecidos de IRAS. A presença confirmada de bactérias patogênicas em sabonetes de uso hospitalar desperta para a necessidade de medidas mais rígidas de desinfecção da área hospitalar.
CONCLUSÃO
Houve contaminação extrínseca dos sabonetes líquidos utilizados para lavagem das mãos, em diferentes setores do hospital, por bactérias patogênicas, como Acinetobacter spp, Enterobacter cloacae, Klebsiella oxytoca, Pantoea spp., Pseudomonas spp., Escherichia coli e Klebsiella pneumoniae.
As cepas bacterianas isoladas apresentaram alta taxa de resistência bacteriana, sendo observado mecanismos de resistência como ESBL e AmpC.
Dessa forma, considerando todas as possibilidades dos microrganismos isolados neste trabalho de manifestarem resistência aos antimicrobianos, favorecendo a infecção em pacientes imunocomprometidos, é de suma importância que os componentes da comissão de infecção hospitalar incluam entre os materiais vistoriados em suas inspeções também os produtos utilizados na instituição, sobretudo aqueles cuja utilidade se presta à prevenção de infecções, como são os sabões e os anti-sépticos.
REFERÊNCIAS
1. Albuquerquer AM, Souza APM, Torquato IMB, Trigueiro JVS, Ferreira JA, Ramalho MAN. Infecção Cruzada no Centro de Terapia Intensiva á Luz da Literatura. Rev. Ciênc. Saúde Nova Esperança 2013; 11 (1):78-87.
2. Oliveira AC, Silva MDM, Garbaccio JL. Vestuário de profissionais de saúde como potenciais reservatórios de microrganismos: Uma revisão integrativa. Texto Contexto Enferm 2012; 21 (3): 684-91.
3. Oliveira AC, Damasceno QS. O papel do ambiente hospitalar na disseminação de bactérias resistentes. Rev Epidemiol Control Infect 2012; 2 (1):28-31.
4. Correal JCD, Marques EA, Guilherme WL, Leão RS, Damasco PV. Infecções por Staphylococcus aureus: mudança do perfil epidemiólogico no Hospital Universitário Pedro Ernesto. Rev HUPE 2013; 12 (3):31-46.
5. Oliveira AC, Cardoso CS, Mascarenhas D. Precauções de contato em unidade de terapia intensiva: fatores facilitadores e dificultadores para adesão dos profissionais. Rev Esc Enferm USP 2010; 44 (1): 161-5.
6. Martinez J, Roseira CE, Passos IPBD, Figueiredo RM. Higienização das mãos: conhecimento dos estudantes. Cienc Cuid Saude 2014; 13 (3): 455-63.
7. Oliveira AC. Infecções hospitalares: repensando a importância da higienização das mãos no contexto de multirresistência. Rev Min Enf 2003; 7 (2): 140-4.
8. Brasil. Ministério da Saúde. Programa Nacional de Prevenção e Controle de Infecções Relacionadas à Assistência à Saúde. Brasília, 2013.
9. Mota EC, Barbosa DA, Silveira BRM, Rabelo TA, Silva NM, Silva PLN, et al.,. Higienização das mãos: uma avaliação da adesão e da prática dos profissionais de saúde no controle das infecções hospitalares. Rev Epidemiol Control Infect 2014; 4 (1): 12-7.
10. Caetano JA, Lima MA, Miranda MDC, Serufo JC, Pontes PRL. Identificação de contaminação bacteriana no sabão líquido de uso hospitalar. Rev Esc Enferm USP 2011; 45 (1): 153-60.
11. Moreira ACA, Carvalho JLM. Ocorrência de Klebsiella pneumoniae e outros coliformes em sabão neutro líquido utilizado em um berçário de hospital. Rev Ciênc Med Biol 2006; 5 (3): 245-52.
12. Koneman EW. Diagnóstico Microbiológico: texto e atlas. 6 ed. Rio de Janeiro: Guanabara Koogan; 2008.
13. Oplustil CP, Zoccoli CM, Tobouti NR. Procedimentos Básicos em Microbiologia Clínica. 3 rd ed. Rio de Janeiro: Sarvier; 2010.
14. Clinical Laboratory Standards Institute. Methods for dilution antimicrobial susceptibility test for bacteria that grow aerobically 2016.
15. Alves JLB, Costa RM, Braoios A. Teclados de computadores como reservatórios de microrganismos patogênicos. J Health Sci Inst. 2014; 32 (1): 7-11.
16. Momeni SS, Tomlin N, Ruby JD. Isolation of Raoultella planticola from refillable antimicrobial liquid soap dispensers in a dental setting. JADA 2015; 146 (4): 241-5.
17. Souza LM, Ramos MF, Becker ESS, Meirelles LCS, Monteiro SAO. Adesão dos profissionais de terapia intensiva aos cinco momentos da higienização das mãos. Rev Gaúcha Enferm. 2015; 36 (4): 21-8.
18. Zapka CA, Campbell EJ, Maxwell SL, et al. Bacterial hand contamination and transfer after use of contaminated bulk-soap-refillable dispensers. Appl Environ Microbiol. 2011; 77 (9): 2898-904.
19. Archibald LK, Corl A, Shah B, Schulte M, Arduino MJ, Aguero S, Fisher DJ et al. Serratia marcescens outbreak associated with extrinsic contamination of 1% chlorxylenol soap. Infect. Control Hosp. Epidemiol. 1997; 18: 704–9.
20. Buffet-Bataillon S, Rabier V, Bétrémieux P, Beuchée A, Bauer M, Pladys P et al. Outbreak of Serratia marcescens in a neonatal intensive care unit: contaminated unmedicated liquid soap and risk factors. J. Hosp. Infect. 2009; 72: 17–22.
21. Weber D J, Rutala WA, Sickbert-Bennett EE. Outbreaks associated with contaminated antiseptics and disinfectants. Antimicrob. Agents Chemother. 2007; 51: 4217–24.
22. Serufo JC. Avaliação da dinâmica de contaminação extrínseca de sabonetes líquidos e anti-sépticos no processo de uso em hospitais brasileiros da rede sentinela. Belo Horizonte: Fundação de Desenvolvimento da Pesquisa (FUNDEP) e Agência Nacional de Vigilância Sanitária (ANVISA), 2009.
23. Assadian O, Kramer A, Christiansen B, Exner M, Martiny H, Sorger A et al. Recommendations and requirements for soap and hand rub dispensers in healthcare facilities. GMS Krankenhaushyg Interdiszip.2012; 7 (1): Doc03.
24. Martins AF, Barth AL. Multidrug-resistant Acinetobacter – a challenge for public health. Scientia Medica 2013; 23 (1): 56-62.
25. Giamarellou H, Antoniadou A, Kanellakopoulou K. Acinetobacter baumannii: a universal threat to public health? Int J Antimicrob Agents. 2008; 32 (2):106-19.
26. Blanc DS, Gomes Magalhaes B, Abdelbary M, Prod'hom G, Greub G, Wasserfallen JB, Genoud P, Zanetti G, Senn L, Hand soap contamination by Pseudomonas aeruginosa in a tertiary care hospital: no evidence of impact on patients. J Hosp Infect. 2016; 93 (1): 63-7.
27. Lima ABM, Leão-Vasconcelos LSNO, Costa DM, Vilefort LOR, André MCDPB, Barbosa MA et al. Pseudomonas spp. isolated from the oral cavity of healthcare workers from an oncology hospital in midwestern Brazil. Rev Inst. Med Trop 2015; 57 (6): 513-4.
28. Kaiser TDL, Santiago DD, Mendes EMT, Matos BV. Detecção de betalactamase de espectro estendido em isolados de enterobactérias provenientes de um hospital da região de Santa Teresa-ES. Arq. Ciênc. Saúde 2016; 20 (1): 3-7.
29. Lago A, Fuentefria SR, Fuentefria DB. Enterobactérias produtoras de ESBL em Passo Fundo, Estado do Rio Grande do Sul, Brasil. Rev Soc Bras Med Trop 2010; 43 (4): 430-4.
30. Lenhard-Vidal A, Cardoso RF, Pádua RAF, Siqueira VLD. High prevalence rate of extended-spectrum beta-lactamases (ESBL) among Enterobacteriaceae in a small Brazilian public hospital. Brazilian Journal of Pharmaceutical Sciences 2011; 47 (4): 701-7.
31. Ouedraogo AS , Sanou M , Kissou A , Sanou S , Solaré H , Kaboré F et al. High prevalence of extended-spectrum β-lactamase producing enterobacteriaceae among clinical isolates in Burkina Faso. BMC Infectious Diseases 2016: 16: 326.
32. Singh N, Pattnaik D, Neogi DK, Jena J, Mallick B. Prevalence of ESBL in Escherichia coli Isolates Among ICU Patients in a Tertiary Care Hospital. Journal of Clinical and Diagnostic Research. 2016; 10 (9): 19-22.
33. Enoch DA , Brown F , Sismey AW , Mlangeni DA , Curran MD , Karas JA et al. Epidemiology of extended-spectrum beta-lactamase-producing Enterobacteriaceae in a UK district hospital; an observational study. J Hosp Infect. 2012: 81 (4): 270-7.
34. Wollheim C, Guerra IMF, Conte VD, Sheila P Hoffman SP, Schreiner FJ, Delamare APL et al. Nosocomial and community infections due to class A extended-spectrum b lactamase (esbla)-producing Escherichia coli and Klebsiella spp. in southern Brazil. Braz J Infect Dis 2011; 15 (2): 138-43.
35. Sengupta M, Banerjee S, Das NK, Guchhait P, Misra S. Early Onset Neonatal Septicaemia Caused by Pantoea agglomerans. Journal of Clinical and Diagnostic Research 2016: 10 (5): 1-2.
36. Mardaneh J, Dallal MMS. Isolation, identification and antimicrobial susceptibility of Pantoea (Enterobacter) agglomerans isolated from consumed powdered infant formula milk (PIF) in NICU ward: First report from Iran. Iran J Microbiol 2013; 5 (3): 263-7.
37. Boszczowski I, Nóbrega de Almeida Júnior J, Peixoto de Miranda EJ, Pinheiro Freire M, Guimarães T, Chaves CE, et al. Nosocomial outbreak of Pantoea agglomerans bacteraemia associated with contaminated anticoagulant citrate dextrose solution: new name, old bug?. J Hosp Infect. 2012; 80: 255–8.
38. Mehar V, Yadav D, Sanghvi J, Gupta N, Singh K. Pantoea dispersa: an unusual cause of neonatal sepsis. Braz J Infect Dis. 2013;17(6):726–8.
39. Van Rostenberghe H, Noraida R, Wan Pauzi WI, Habsah H, Zeehaida M, Rosliza AR, et al. The clinical picture of neonatal infection with Pantoea species. Jpn J Infect Dis. 2006; 59: 120–1.